| 【問題2】解答 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 問1 (1) 4:5 (2) 1.5atm 問2 44 問3 67% 問4 0.16mol 問5 0.34atm 問6 (1) 0.2mol (2) 6.5atm (3) 8.6atm ※解説※ 問1 気体の状態方程式を使って強引に考えることも可能だが,ここでは具体像を追って考えていこう。その方が気体の問題に強くなれるんだ。 (1) 具体像が浮かびにくいなら「同温で同じ質量分だけ同じ大きさの容器に詰め込んだ」と考えてみればいい。さらに具体的にするためには「酸素1mol分と同じ質量だけ,アルゴンと酸素を同一の容器2つに別々に詰め込んだ」と考えてみればいい。
要は,同質量の物質2つをとれば,「分子数の比」は「分子量の比」の逆になるということなのだが,気体になってくると何故かピンとこなくなりやすい。 (2) 「同温,同体積なら,分子数が2倍になれば圧力も2倍,分子数3倍になれば圧力も3倍」になるから, 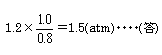 問2 やっぱりちょっとビビってしまうのは,容器の大きさや温度などの条件が具体的に与えられていないところだ。ちょっと具体的に考えてみよう。 温度と容器の体積だが,0℃,22.4 0℃,22.4 それじゃ,同じ温度で同じ容器に0.91atmになるように気体を詰め込んだら何モルになるか? そう,0.91molになるね。 要するに,窒素の代わりに容器に入れた気体は1.46molの窒素と同じ質量で0.91molになるということだ。 窒素の分子量は28だから,未知の気体の分子量は窒素の分子量の この問題の要は,「同じ質量の場合,圧力比は分子量の逆比となる」ということなんだが,このことを気体の状態方程式を用いてではなく,上のように具体像でしっかり把握しておこう。 でないと,気体の難問題にぶち当たったとき,歯が立たなくなってしまいやすい。気体の問題は,慣れるまではじっくり具体像を追っていこうね。 問3 分解の反応式を書くと, 閉鎖している容器の中で,中に気体しか存在しないわけだから,どのくらい分解したかによってだけで圧力が決まる。それならば圧力だけで答を求められるはずだ。もしアンモニアが全然分解しなかったら圧力はどうなるかを考えてみよう。 で,実際には58atmだったのだから,圧力の増加分は だから,分解率は 問4 沸騰するってどういうことかというのがまずポイント。 「蒸気圧」が「大気圧」に等しくなった時に沸騰する(その温度を沸点という)わけだから,気相の窒素の圧力は大気圧と等しい,すなわち1atmであると考えればよい。 ということは,−196℃,1.0 の窒素のモル数を求めればいいわけだ。 <別解> 窒素のモル数をnとすると,気体の状態方程式より, 1×1=n×0.082×77 ∴ n=0.16(mol) 問5 ちょっとまず問題を読み替えよう。 平衡状態ということは,「実際には反応しているが,一見あたかもその比率で混合して反応が起こっていないかのようだ」ってことでもあるよね。 となると問題文の条件は 「 分圧は物質量の比率を圧力で表したものでもあるから,当然,混合比がわかれば分圧も出てくるね。じゃ,混合比を求めよう。具体的に考えるために容積を0℃,1atmで,22.4
全体の 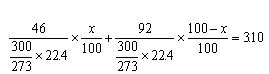 これを解いて, 問6 (1) 1:1に混合したから,エタンの物質量は,27℃における圧力は2.0atm,5.0 よって, <別解> エタンのモル数をnとすると,エタンの分圧 (atm)となるから, 気体の状態方程式より, 1×5=n×0.082×300 ∴ n=0.20(mol) (2) 容器A,Bについてそれぞれ,当該温度でいかなる物質量に相当するのかという観点で整理してみよう。
要するに,初め容器Bには13 <別解> 混合時15 初め容器Aに入っている気体は1atmに換算すると5×2=10( ゆえに容器Bには1atm,27℃,65 相当の物質が10 に圧縮されて存在していると考えればよく,65÷10=6.5(atm) (3)
となるから, 【特別講義(1)】へ 【問題3】へ飛ぶ 【問題2】に戻る
|
||||||||||||||||||||||||||||||||||||||||||||||||