【問題2】
次の各問いに答えよ。必要があれば,気体定数は0.082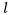 ・atm/(mol・K), ・atm/(mol・K),
原子量は H:1,C:12,N:14,O:16,Ar:40 を用いよ。
問1
同温で同体積のアルゴンと酸素の質量を計ったところ,同じであった。
(1) このときのアルゴンと酸素の分子数の比を求めよ。
(2) このときのアルゴンの圧力を計ると,1.2atmであった。酸素の圧力を求めよ。
問2
1.43atmの窒素が入っていた容器に,窒素の代わりに他の気体を同じ質量入れたら,同温で0.91atmを示した。この気体の分子量はいくつか。整数値で答えよ。
問3
20℃でアンモニア1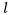 の容器に14.5atmになるまでつめ,ある時間427℃に保ったら,アンモニアの一部が水素と窒素に分解し,圧力が58atmになった。このとき,アンモニアの何%が分解したか。整数値で答えよ。 の容器に14.5atmになるまでつめ,ある時間427℃に保ったら,アンモニアの一部が水素と窒素に分解し,圧力が58atmになった。このとき,アンモニアの何%が分解したか。整数値で答えよ。
問4
液体窒素の沸点は−196℃である。沸点において液体窒素と平衡状態にある気相の窒素1.0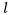 のモル数を有効数字2桁で求めよ。 のモル数を有効数字2桁で求めよ。
問5
27℃,1atmで,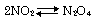 反応が平衡状態である。この混合気体の密度は3.1g/ 反応が平衡状態である。この混合気体の密度は3.1g/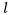 であった。 であった。 の分圧を有効数字2桁で求めよ。 の分圧を有効数字2桁で求めよ。
|
問6
2つの金属製耐圧容器A,Bが,図のようにバルブCをはさんで細いパイプで接続されている。AとBの容積はそれぞれ5.0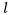 と10.0 と10.0 である。 である。
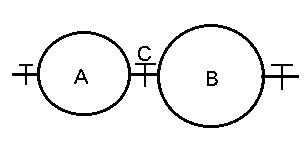
[操作1]
バルブCを閉じ,真空にした容器Aに体積比1:1のアルゴンとエタンの混合気体を充填したところ,27℃における圧力は2.0atmであった。
[操作2]
同様に,真空にした容器Bに体積比1:1のアルゴンと酸素の混合気体を充填し,27℃で圧力を測定した。次に両容器を27℃に保ちながら,バルブCを開いて気体を混合し,両容器内に均一に拡散するまで放置した後に圧力を測定したところ5.0atmであった。
[操作3]
バルブCを開いた状態で耐圧容器A,Bを227℃まで加熱し,適当な方法で混合気体中のエタンを完全に燃焼させた。反応後,水は水蒸気として存在し,容器A,B以外の部分の容積,装置全体の熱膨張は無視する。
次の(1)〜(3)の結果は四捨五入により小数第1位まで求めよ。
(1) 操作1で容器Aに含まれていたエタンは何molか。
(2) 操作2でバルブCを開いて気体を混合する前の容器Bの圧力を求めよ。
(3) 操作3で燃焼後227℃における混合気体の全圧を求めよ。 |
|