| 【問題1】解答 | ||||||||||||||||||||
気体では同温、同圧の条件下で分子量比がそのまま単位体積当たりの質量比になるから,酸素より軽い気体状の炭化水素とは,酸素分子の分子量(=32)未満の炭化水素であり,それは, の4つしかない。それぞれの燃焼式を作ってみると,次のようになる。 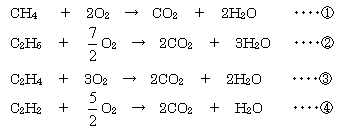 問(ア)
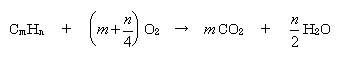 問(イ) 混合気体Aをつくる2種類の炭化水素の混合比と混合気体Bをつくる2種類の炭化水素の混合比をどのように変えても,ピストン1は反応前の位置に戻ってくるためには,気体の双方が燃焼前後で物質量の変わらない炭化水素でなければならない。上反応式よりそのような組み合わせは①と③のケースであることが明らかである。よって条件に合う組み合わせは問(ウ) 混合気体Bをつくる2種類の炭化水素の混合比を変えるとピストン2の戻る位置は変わるが,物質量の比で1:1の場合だけは反応前の位置に戻ってくるためにははじめの物質量比が1:1の時に限って反応後の物質量が反応前と変わらなくなるということである。 ※解説※ この問題では、酸素より軽い気体状の炭化水素という条件と「気体では同温同圧の条件下で分子量比がそのまま単位体積当たりの質量比になる」という基本中の基本事項を用いて、初めに該当する炭化水素を絞り込んでしまうこと及び具体的な炭化水素の燃焼式とモル数を結びつけて考えることが問題解決を楽にするのです。 炭化水素1モルあたりの反応について、反応前後で物質量(要するに「モル」ですね〜)の合計を追っかけてみると下のようになりますね。
ちゃんとこうやってはじめに物質量を追っかけちゃうと、目星がついてきます。 慣れると見ただけで見当がついて、あとはどう書くかだけが問題。(要するに作文)。まあ、はじめから組み合わせの数が6つしかないので、簡潔に書けないときは全部のケースで個々に検証してずらずら書くのも手には手、よもや×はつけられまい。 ところが、いろんな問題集の解答の中には、初めに該当する炭化水素を絞り込まない上に、具体的な炭化水素の燃焼式ではなく、問(ア)のような一般化した燃焼式を使って解こうとして、わざわざ難しく解いているケースがあるんですね。いくつかありますが、どれにせよ、もうこりゃ、『珍解答!!』としか言いようがない。 問(ア)を「誘導」だと決めつけてしまうと「一般の燃焼式」を持ち出したくなるのはわからないでもないけど、これは『誘導に乗る』を金科玉条にしていると陥りやすい罠なんです。 ほーんと、気体の問題と言えば、何とかの一つ覚えのように状態方程式を振り回し、易しい問題をわざわざ難しく解いている受験生が多いんですよ〜。ただこれは、参考書や問題集も状態方程式を振り回して解いているものが多いので、必ずしも受験生のせいばかりではありませんが・・・・ 大体、状態方程式ってのは「温度」「物質量」「圧力」「体積」「標準状態の体積」とまあ、いろんな要素を突っ込んで万能型にしてるもんですから、これを使うと何かと複雑になりやすい。使わずにすむなら使わないで済ませた方が利口ってもんです。 気体の問題に強くなりたければ、状態方程式よりも基本概念と物質の挙動を重視することが大切です。 |